シリーズ科学的助言Vol.4 医薬評価分野の科学的助言

- PROFILE
- 東京大学薬学部薬学科卒業。厚生省(当時)に入省し、医療機器審査管理室長、基準審査課長、安全対策課長を歴任。2013年7月から独立行政法人医薬品医療機器総合機構(PMDA)に出向。2015年6月から現職。
医薬評価分野における科学的助言と行政判断
医薬品や医療機器等は国民の健康、生命に直接かかわる資源であり、有効かつ安全で品質も安定していなくてはなりません。これらの条件を満たすため、医薬品等の製造販売には事前に厚生労働大臣の承認を得ることが義務付けられています。また、市販後も有効性、安全性及び品質に関する情報を収集し、必要な対策を講じていくことが求められます。独立行政法人医薬品医療機器総合機構(Pharmaceuticals and Medical Devices Agency : PMDA)は、文字通り医薬品や医療機器についての科学的助言を行う組織であり、厚生労働大臣はPMDAの助言を踏まえて承認の可否や必要な安全対策を判断しています。
PMDAは申請企業から提出される毒性試験、薬理試験、性能試験、品質試験といったデータを評価し、その結果を審査報告書にまとめ厚生労働大臣に提出します。厚生労働大臣は審査報告書をもとに薬事・食品衛生審議会の意見を聞き、承認を与えるか否かの判断を行っています。市販後も副作用や不具合の情報を評価し、厚生労働省が新たな安全対策を講じる際にはPMDAの調査結果をもとに関係企業へ対策実施を指示します。
PMDAによる科学的助言は、医薬品等のリスクとベネフィット両面を評価したうえでバランスを見極めて行われます。例えば、重い副作用が生じることが分かっていても、がんなどの命に係わる重篤な疾患に効果がある場合には、承認が妥当との科学的助言を行うこともあります。
レギュラトリーサイエンスに基づく科学的助言と科学委員会
PMDAの科学的助言はレギュラトリーサイエンスの基礎の上で行われています。第4次科学技術基本計画(平成23年8月19日閣議決定)ではレギュラトリ-サイエンスを、「科学技術の成果を人と社会に役立てることを目的に、根拠に基づく的確な予測・評価・判断を行い、科学技術の成果を人と社会との調和の上で最も望ましい姿に調整するための科学」と定義しています。「規制」の科学であると受け取られがちですが、その実「調整」の科学です。医薬評価の場面では、科学技術の成果である医薬品や医療機器等を必要としている患者さんに、リスクをできる限り小さくして届けられるようにすることであり、そのための試験・評価方法・評価基準の策定、リスク最小化のための仕組み作り、すべてがレギュラトリーサイエンスです。
PMDAはレギュラトリーサイエンスを積極的に推進し、革新的医療技術を必要とする患者に迅速に届けるため、医学、歯学、薬学、工学などの外部専門家を構成員とする科学委員会を設置しています。科学委員会では先端科学技術の現状やその評価のための考え方の議論が行われています。例えば、平成24年から平成26年にかけての第一期では、iPS細胞等の細胞組織加工製品ががん化する可能性をどう評価するのか、考え方のとりまとめを行いました。
平成30年3月までは第三期の委員会が組織されており、人工知能(AI)をテーマの一つとしています。AIを活用した新技術の医療関連分野の研究開発が急速に進められていることを受け、AIを用いた医療機器の審査や相談には従来技術に加えてどのような新しい観点が重要なのか、「AIとしての新要素」をAI専門家や医療情報の専門家が検討しています。
医薬評価分野における新たな取組み
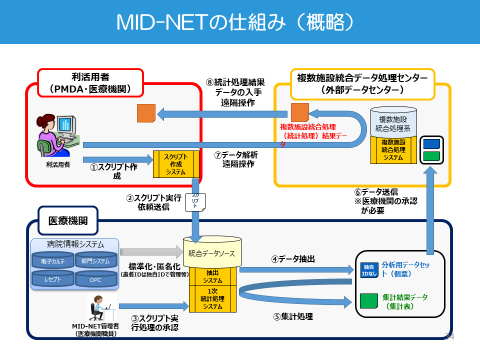 また、PMDAはレギュラトリーサイエンスの一貫として、電子カルテなどの電子的診療情報を安全対策等へ活用していくために新たな取組みを進めています。MIHARI (Medical Information for Risk Assessment Initiative)というプロジェクトでは、電子カルテやレセプト情報といった電子化された医療情報を用いた薬剤疫学的な解析と並行して分析手法の高度化を図り、医薬品のリスク・ベネフィット評価や、安全対策への活用促進を目指しています。さらに、MIHARI で利活用する医療情報データベースのひとつとして、10拠点23病院 の電子的診療情報をほぼリアルタイムに利活用できる分散型データベースネットワークMID-NETⓇを構築しています。MID-NETⓇは参加医療機関の電子カルテ、レセプト、DPCのコード化された情報を標準化してデータベース化したもので、病名、処方薬、検査といった情報に加え、治療の成果である臨床検査値データも利用できることが最大の特徴です。このネットワークは平成30年度に本格稼働する予定です。
また、PMDAはレギュラトリーサイエンスの一貫として、電子カルテなどの電子的診療情報を安全対策等へ活用していくために新たな取組みを進めています。MIHARI (Medical Information for Risk Assessment Initiative)というプロジェクトでは、電子カルテやレセプト情報といった電子化された医療情報を用いた薬剤疫学的な解析と並行して分析手法の高度化を図り、医薬品のリスク・ベネフィット評価や、安全対策への活用促進を目指しています。さらに、MIHARI で利活用する医療情報データベースのひとつとして、10拠点23病院 の電子的診療情報をほぼリアルタイムに利活用できる分散型データベースネットワークMID-NETⓇを構築しています。MID-NETⓇは参加医療機関の電子カルテ、レセプト、DPCのコード化された情報を標準化してデータベース化したもので、病名、処方薬、検査といった情報に加え、治療の成果である臨床検査値データも利用できることが最大の特徴です。このネットワークは平成30年度に本格稼働する予定です。
レギュラトリーサイエンスセンターの設置
医薬評価分野におけるレギュラトリーサイエンスの重要性から、PMDAは平成30年度に「レギュラトリーサイエンスセンター」を設置する予定です。承認申請資料として提出される臨床試験に係る電子データに加え、MID-NETⓇから得られる現実の電子的診療情報を積極的に活用し、「承認審査及び安全対策の品質向上」と「科学的エビデンスに基づくガイドライン作り」を重点的に進めていきます。これにより、日本で革新的な医薬品や医療機器等を研究開発する際に、初期段階の相談から承認審査、安全対策まで一貫して科学的根拠に基づいた予測や評価、判断、すなわち質の高い科学的助言を提供することができると考えています。